GGO’s
DNA bevat informatie over de erfelijke eigenschappen van de soorten. Op het DNA liggen genen. Deze genen coderen via eiwitten voor het fenotype van het organisme. Met nauwkeurige knip instrumenten (Crisper-cas) is de wetenschap in staat zeer nauwkeurig genen uit het DNA van organismen te knippen. Het verwijderen van genen en het inbrengen van deze genen in een ander organisme heet genetische modificatie. Over deze knutseltechnieken met DNA gaat deze les.
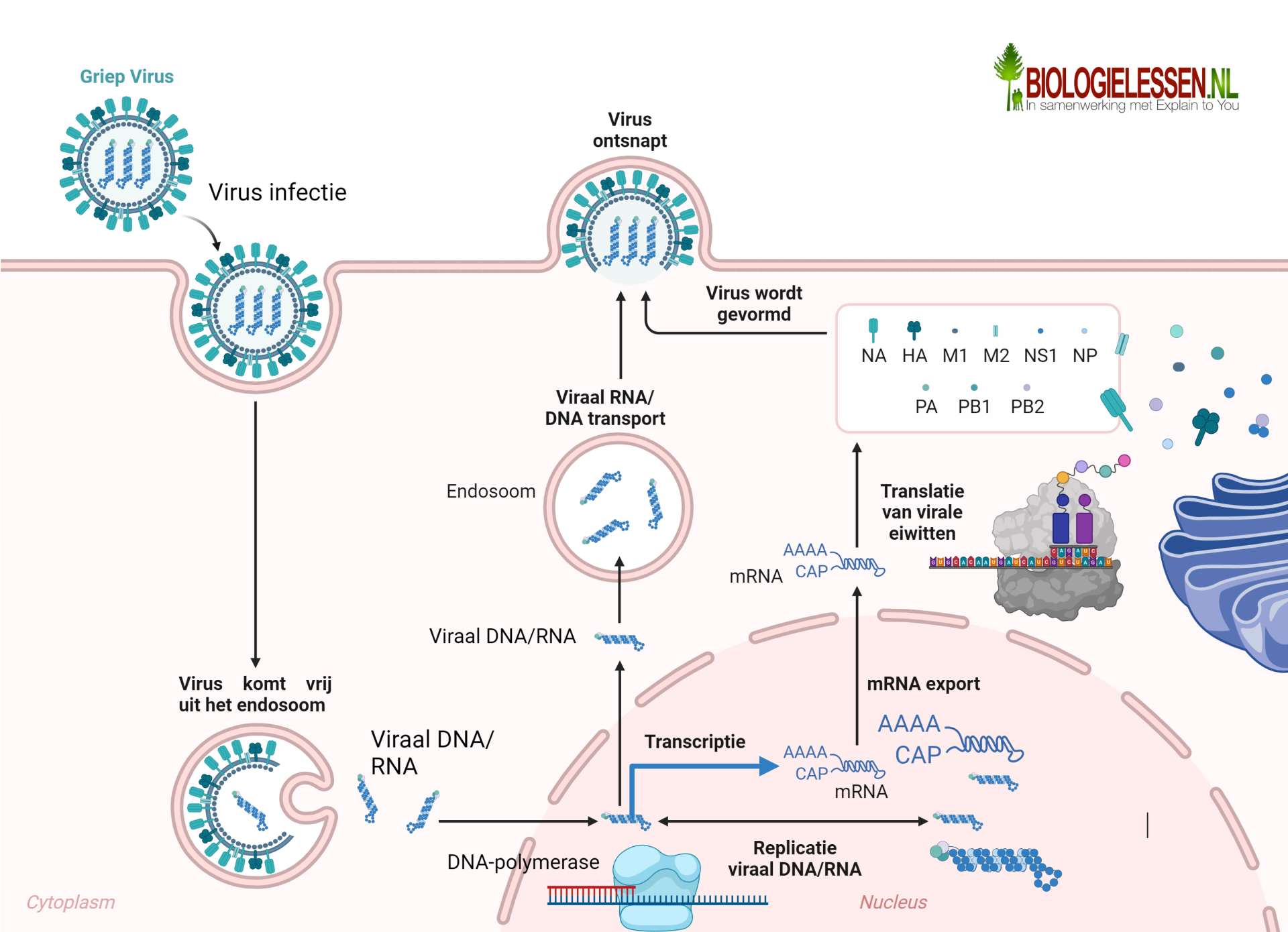
Meesters van het inbrengen van stukjes DNA in een gastcel zijn de virussen. Virussen infecteren de gastcellen. Bij deze infectie komt het DNA van het virus terecht in de celkern van de gast. Dit is te zien op bovenstaande afbeelding. Met behulp van meegeleverde enzymen kan het viraal DNA worden ingeplakt in het DNA van de geïnfecteerde gastcel. Op deze manier kan het DNA jaren lang in het DNA van de gast zitten. Tot het moment dat het virus wil “ontsnappen”. Als de tijd daar is neemt het virus de gehele machinerie van de gastheer over. Met behulp van het enzym DNA-polymerase worden er in een proces dat we replicatie noemen vele erfelijkheidsdragers van het virus-DNA geproduceerd. RNA-polymerase zorgt in een proces dat we transcriptie noemen voor de productie van veel strengen viraal m-RNA. Het virale m-RNA verlaat de celkern en zorgt met behulp van de ribosomen van de gast voor de productie van vele virale eiwitten waaruit het virus is opgebouwd. In het cytoplasma komen viraal DNA (of RNA) en de geproduceerde eiwitten bij elkaar en worden er vele nieuwe virussen gevormd. De nieuwe virussen ontsnappen. De gastheer sterft.
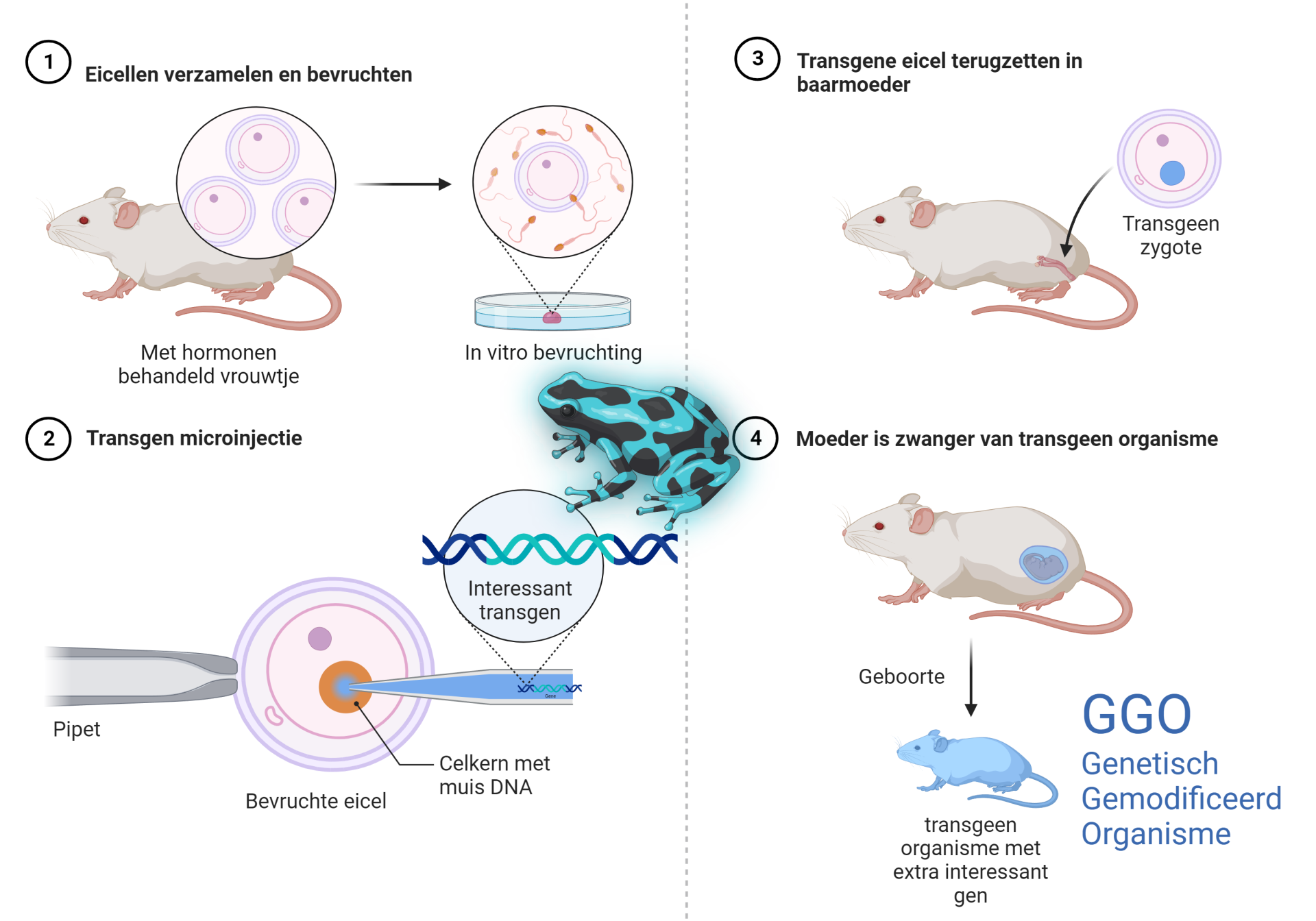
DNA is ook op een andere manier in te brengen in het DNA van een gastheer. Een organisme dat DNA krijgt van een andere organisme moemen we een Genetisch Gemodificeerd Organisme of afgekort GGO. Het proces waarbij we genen verplaatsen van de ene soort naar een andere soort noemen we genetische modificatie. Door genetische modificatie kun je planten en dieren interessante eigenschappen geven die ze eerst niet hadden. Door genetische modificatie kun je er bijvoorbeeld voor zorgen dat planten kunnen groeien op een zilte (licht zoute) bodem. Of je zou ervoor kunnen zorgen dat een plant minder water nodig heeft. Of dat een plant extra bescherming krijgt tegen insecten vraat, zodat je als boer minder insecticiden hoeft te gebruiken. Genetische modificaties worden toegepast om de mens te dienen. In de afbeelding hierboven zie je hoe genetische modificatie en het ontstaan van een GGO technisch uitvoerbaar is. De wetenschappers oogsten een grote hoeveelheid eicellen uit een muis. In vitro (in glas) zorgen ze voor bevruchting. Zo ontstaan er vele bevruchte diploide cellen. Ondertussen heeft men uit een andere soort een “interessant” gen geknipt en geïsoleerd. In dit geval een gen dat zorgt voor de blauwkleuring van de huid van een kikker. Het gen wordt in het DNA van de muis-eicellengebracht en men hoopt dat het nieuwe gen op de juiste plek wordt ingebouwd. Als het interessante gen daadwerkelijk is ingebouwd in het genoom van de muis, dan wordt deze teruggeplaatst in de baarmoeder van de muis. Deze is dan nu zwanger van een genetisch gemodificeerde eicel of een trangene eicel (zygote). In de baarmoeder zal deze zygote uitgroeien tot een jonge muis met het transgen in al zijn cellen. In specifieke cellen en weefsels zal het gen tot uiting komen. In dit geval zal er een blauwe muis geboren worden. Er is een organisme ontstaan met een geheel nieuwe gewenste eigenschap.
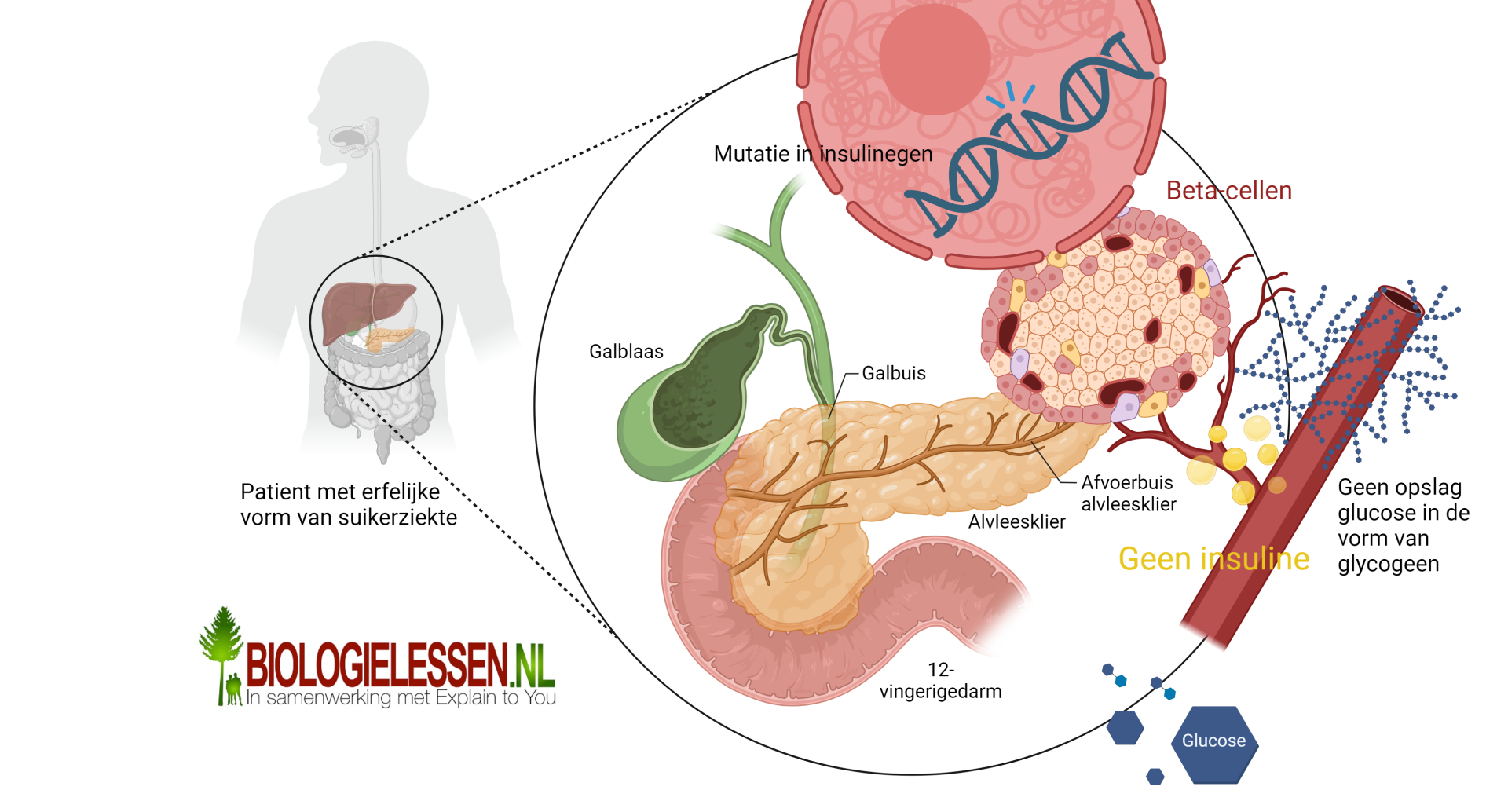
Maar ook in de medische wereld wordt genetische modificatie toegepast. Stel we hebben een individu met een genetisch defect in het insulinegen (zie bovenste afbeelding). Door dit defect zal het individu niet in staat zijn werkend insuline te produceren. Het individu is dan suikerpatiënt. Bij suikerpatiënten kan het zo zijn dat de Beta-cellen in de alvleesklier niet werkend of zelfs geen insuline produceren. Werkend insuline zorgt ervoor dat de bloedsuikerspiegel na een maaltijd niet al te hoog wordt. Na een maaltijd zorgt het vrijgekomen insuline ervoor dat alle cellen van het lichaam, maar vooral de cellen van de lever, spieren en vetcellen, glucose gaan opnemen. Insuline zorgt in de betreffende cellen voor de aanmaak van glucosepoorten. Via deze poorten nemen de cellen glucose op uit de bloedbaan. De cellen zetten de opgenomen glucose om in glycogeen. Zonder glucose geen poorten en zonder poorten geen opname van glucose en dus geen verlaging van de bloedsuikerspiegel.
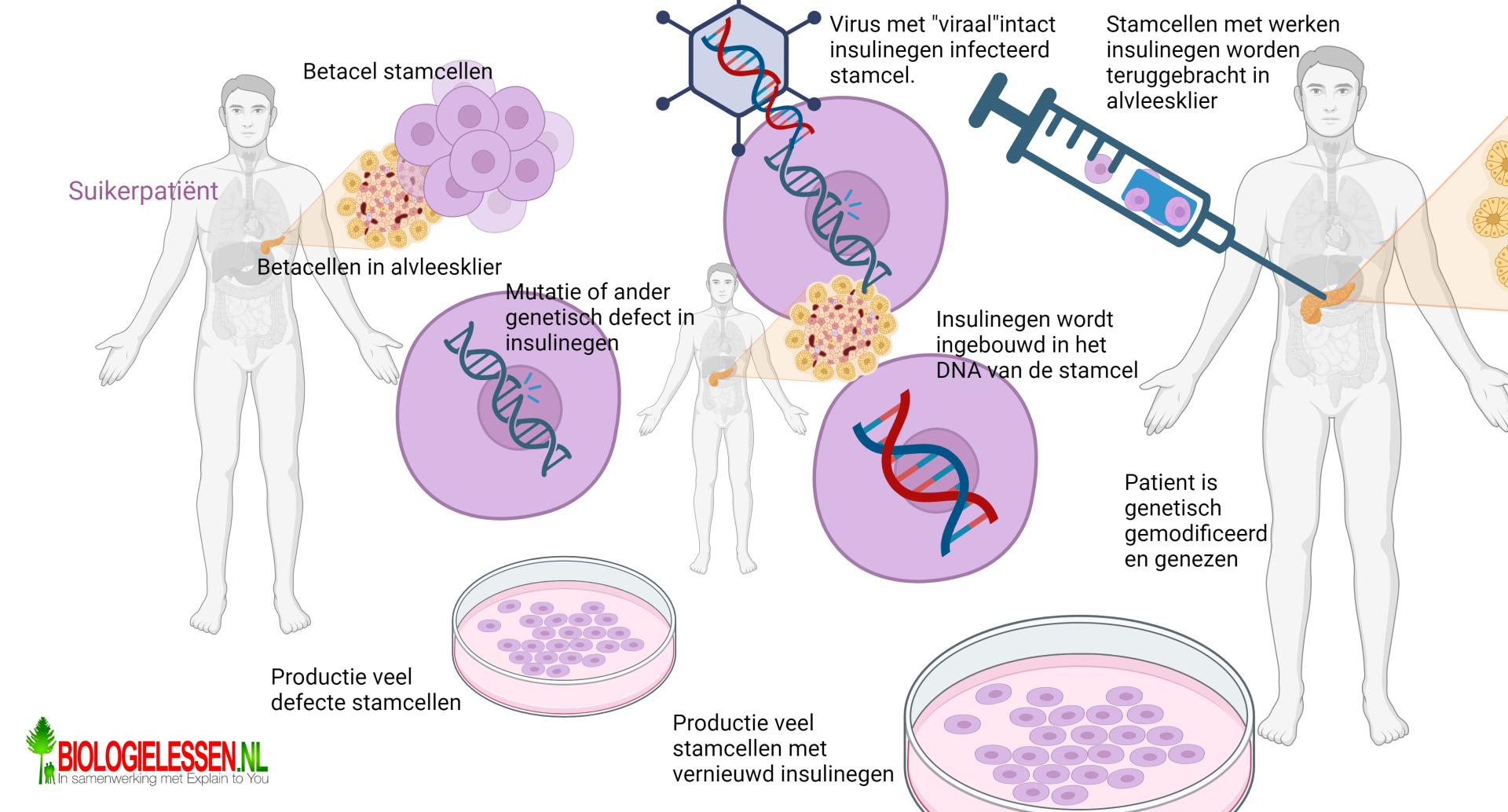
Hoe genetische modificatie een suikerpatiënt kan helpen zie je op de bovenstaande afbeelding. Uit de alvleesklier worden stamcellen met het defecte insulinegen gehaald. In vitro worden de geoogste stamcellen gekloond tot een behoorlijk aantal stamcellen met nog steeds een defect insulinegen. Ondertussen haalt men uit een niet suikerpatiënt een werkend insulinegen. Dit gen stopt men in een speciaal aangepast virus. Het virus wordt vervolgens in contact gebracht met de stamcellen en men hoopt dat het virus de stamcellen infecteert met het werkende insulinegen en dat het insulinegen op de juiste plek in het genoom van de stamcellen wordt ingebouwd. Bij een deel van de stamcellen zal dat niet lukken, maar een bij een aantal andere stamcellen zal het virale insulinegen op de juiste plek in het genoom van de stamcel worden ingebouwd. De genetisch gemodificeerde stamcellen worden vervolgens teruggezet in de eilandjes van Langerhans in de Alvleesklier. Elke Beta-cel die uit deze stamcel zal ontstaan zal een werkend insulinegen hebben en werkend insuline kunnen produceren. Naar mate de tijd vordert zal de patiënt zelf steeds meer insuline gaan produceren.
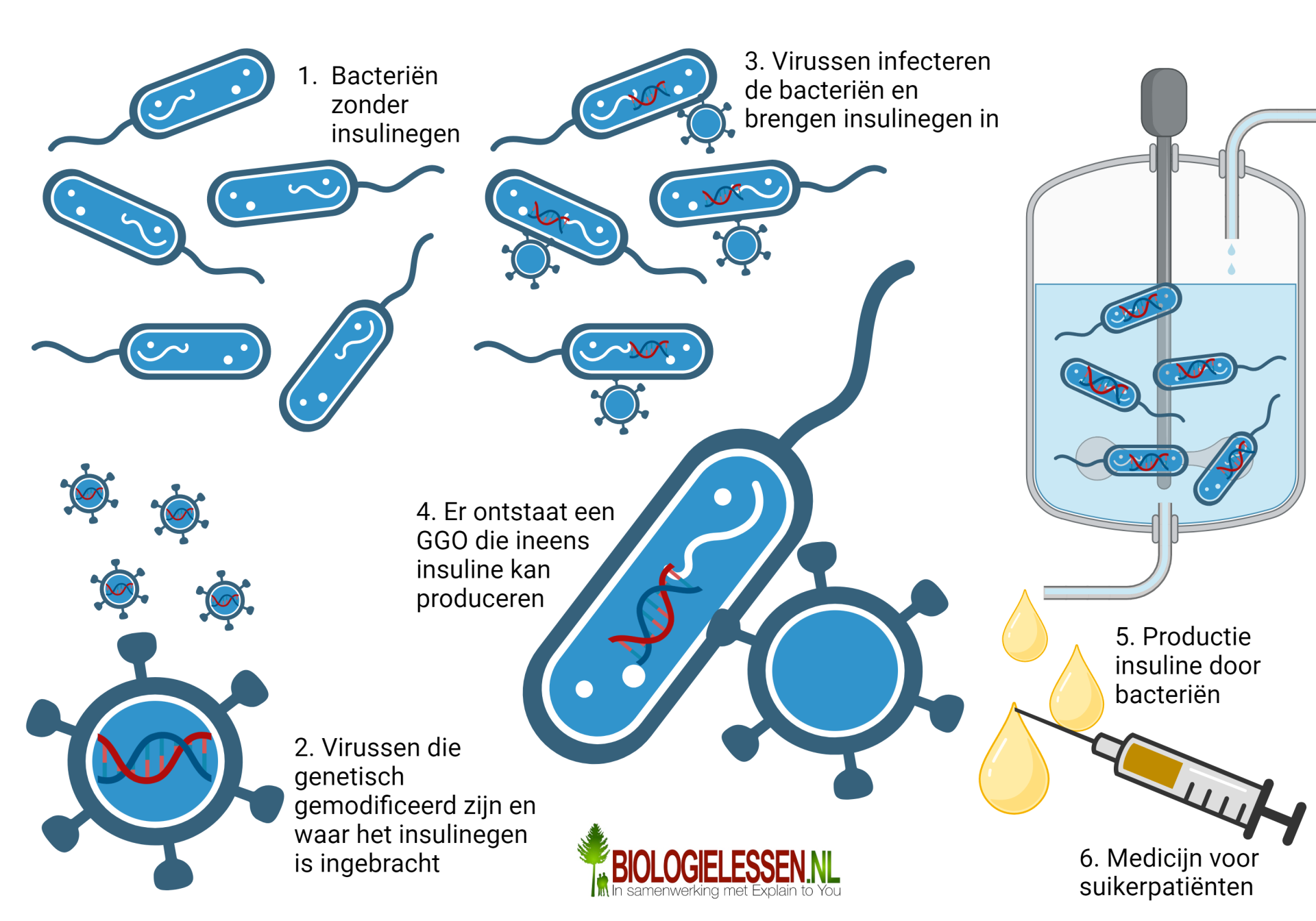
De recombinante bacterie is een andere goede toepassing van genetische modificatie. Met deze techniek laten we weer een bacterie infecteren door een genetisch gemodificeerd virus. Het gemodificeerde virus kan na de infectie een gen inbrengen in de bacterie. Bijvoorbeeld weer het insulinegen. Ook hier zullen een heleboel bacteriën niet worden geïnfecteerd, of het gen verkeerd ingebouwd. Bij een aantal bacteriën zal het infectieproces goed verlopen en zal het insulinegen worden ingebouwd in het bacteriële DNA. Er ontstaat nu een genetisch gemodificeerde bacterie met een nieuwe genetische eigenschap, namelijk insuline produceren. De GGO bacteriën kunnen vervolgens worden opgekweekt in hele grote cilinders die we voorzien van voedsel en zuurstof voor de bacteriën. De insuline die door deze bacteriën wordt uitgescheiden kan worden gebruikt als medicijn voor suikerpatiënten.
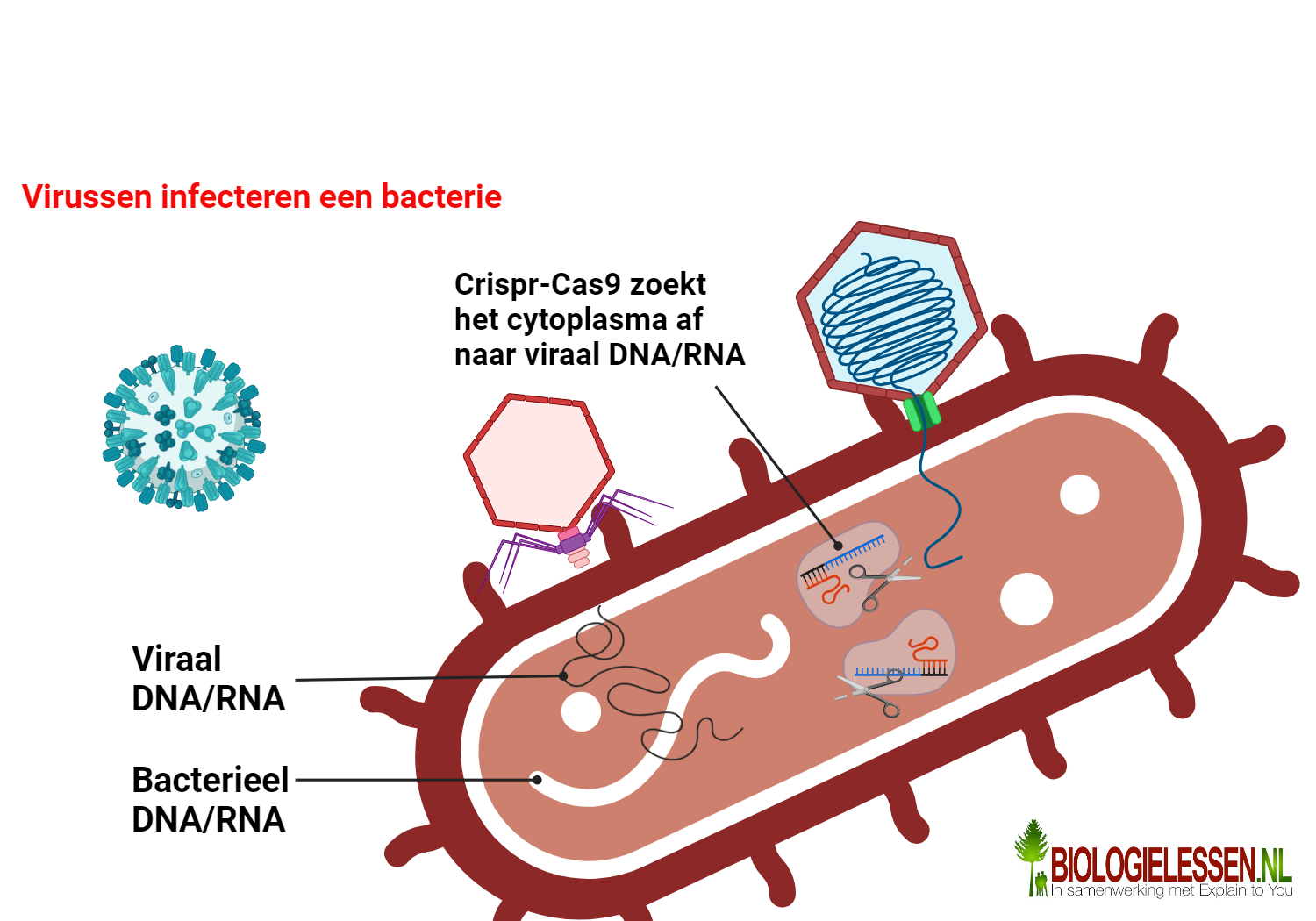
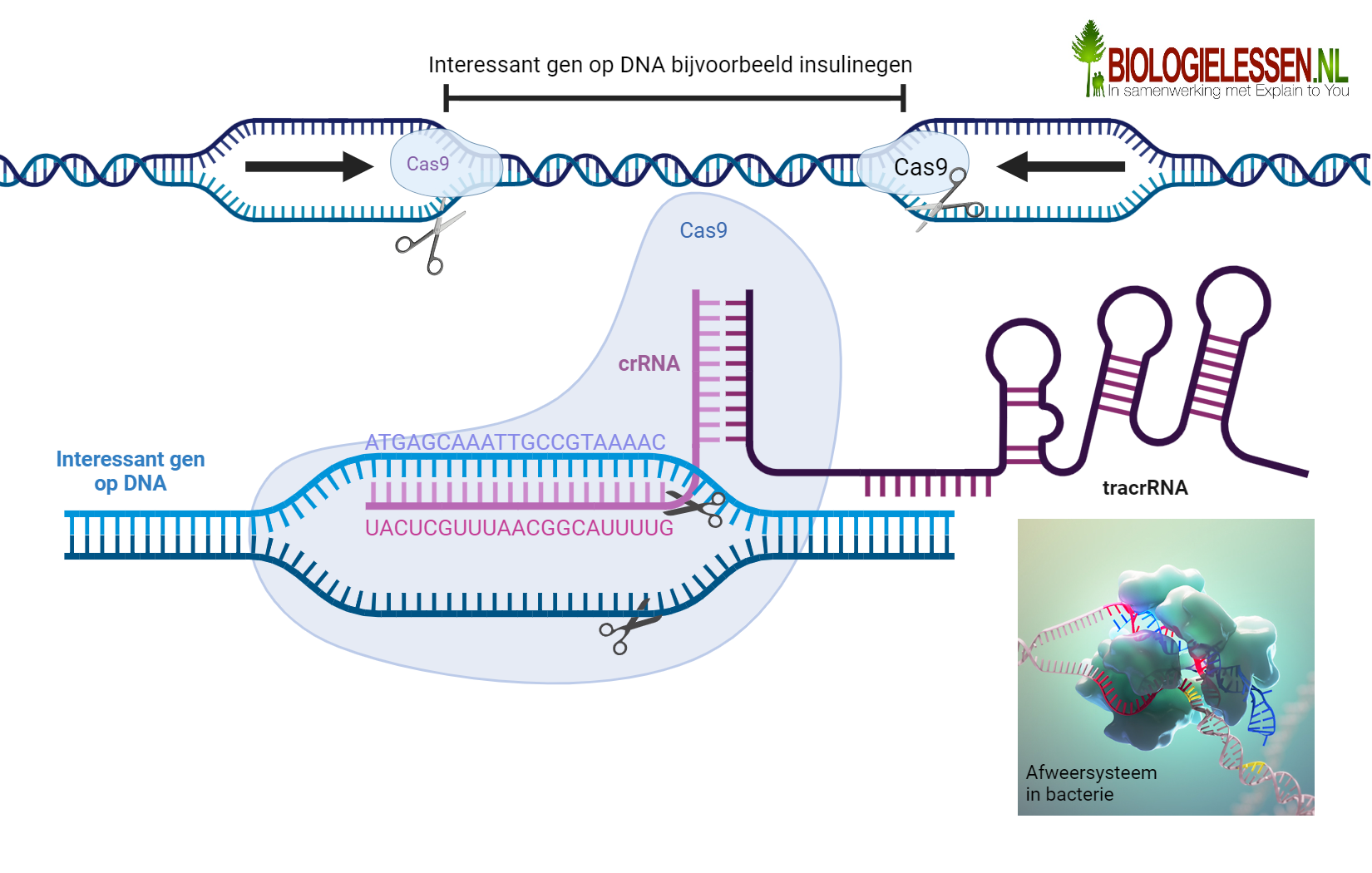
Crisper-Cas9 is eigenlijk een enzym (Cas-9) met een stukje (vijandig viraal erfelijk materiaal (Crispr). CRISPR wordt in de jaren tachtig voor het eerst aangetroffen bij bacteriën. Later blijkt het om een afweermechanisme tegen virussen te gaan. Geen overbodige luxe voor bacteriën: virussen vermoorden elke dag miljarden en miljarden bacteriën. In een ver evolutionair verleden ontwikkelen bacteriën een manier om zich daar tegen te beschermen: door stukjes virus-DNA op te slaan in hun eigen DNA. Deze CRISPRs zijn het geheugen van het afweersysteem van de bacterie (zie bovenstaande afbeelding). Zo kunnen ze hun belagers in het vervolg herkennen – ze hebben altijd een genetische ‘foto’ van de vijand bij zich. Het enzym Cas-9 functioneert dan als een soort schaar. Daar waar de crispr aangeeft knipt de Cas-9 het DNA in stukjes. De virale infectie is dan bestreden. De bacterie heeft het deze keer gewonnen van het virus
De wetenschappers Jennifer Doudna (Universiteit van Californië) en Emmanuelle Charpentier (Max Planck Institut Berlijn) ontdekten in het laboratorium dat ze dit Crispr-Cas9 afweermechanisme zelf konden modificeren door het Cas-9 enzym te voorzien van steeds andere nucleotidenvolgorde. Door het Cas-9 enzym te voorzien van gewenste stukjes DNA, zal het Cas-9 in het DNA op zoek gaan naar complementerende stukjes DNA en deze verwijderen. Hiermee is men nu dus in staat om op de nucleotide nauwkeurig een gen uit het DNA te verwijderen. Met deze revolutionaire techniek is het heel makkelijk defecte genen uit het genoom van een individu te verwijderen en te vervangen door een perfect uitgeknipt werkend gen.
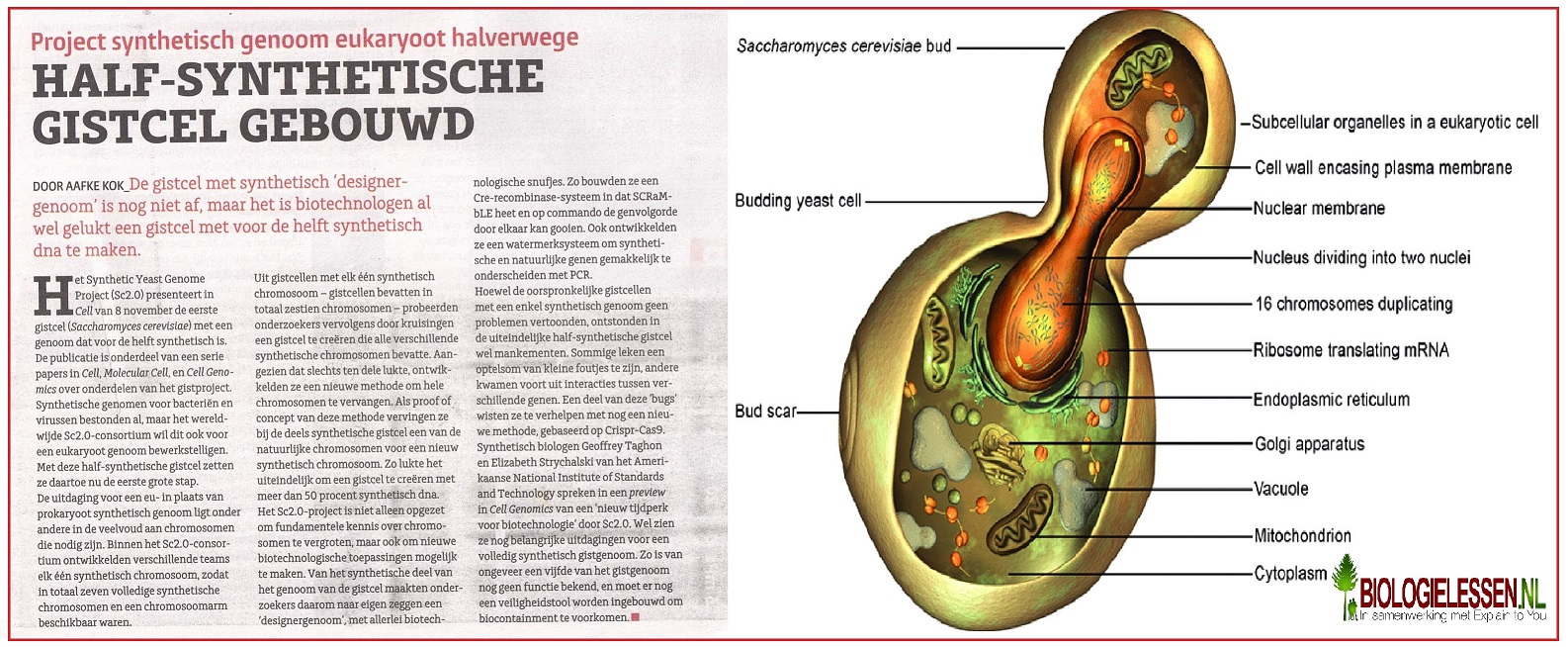
Nog een stapje verder, en toch nog wel serieuze toekomstmuziek is het creëren van een geheel synthetischgenoom. In het laboratorium worden de nucleotiden in de gewenste volgorde aaneengeregen. Er worden dan synthetische strengen DNA of synthetische chromosomen gevormd, die geplaatst in een cel deze cel tot leven moeten brengen of in leven moeten houden. Pionier op dit gebied is Creg Venter die al jaren geleden een compleet synthetisch genoom voor een bacterie (Synthia) maakte. Op het het moment van schrijven zijn wetenschappers bezig met het synthetisch creëren van DNA van een eukaryoot. (Zie onderstaande artikel). Dat gaat nog wat moeizaam, omdat gist meer chromosomen en meer genen heeft dan de prokaryoot Synthie. Op Biologielessen.nl is hier een gehele les aan besteed.