Geschiedenis van het DNA door de tijd.
Knutselen met genen
De genetische informatie van alle organismen ligt op het DNA of RNA. De meeste, zoniet alle eukaryoten hebben DNA als erfelijkheidsdrager. Vele procoryoten hebben RNA als erfelijkheidsdrager. Een goede erfelijksdrager waar de natuurlijke selectie wat mee kan, moet aan drie belangrijke voorwaarden voldoen. Deze voorwaarden zijn:
- Moet zichzelf kunnen kopiëren (repliceren).
- Dit replicatieproces moet snel en efficient gaan, maar niet foutloos. Er moeten mutaties in kunnen optreden.
- Deze mutaties moeten kunnen worden doorgegeven aan het nageslacht.
DNA en RNA een evolutionair overzicht
DNA en RNA voldoen beide aan bovenstaande drie eigenschappen. Bij het DNA ontstaat hier echter een evolutionair probleem. Om zichzelf te kunnen kopiëren heeft DNA weer eiwitten nodig en eiwitten hebben weer DNA nodig om te kunnen ontstaan. Dus zonder eiwitten geen DNA, maar zonder DNA ook geen eiwitten. Ervan uitgaande dat ook DNA geëvolueerd is, is het handig aan te nemen dat RNA de voorloper van het DNA is. Dat eerst in de evolutie het RNA is ontstaan, en later, uit dit RNA, de verbeterde erfelijkheidsdrager DNA. RNA heeft namenlijk het eerder geschetste eiwitprobleem niet. RNA kan functioneren als erfelijkheidsdrager, maar het kan tevens dienen als eiwit. Als het RNA zich op speciale manieren opvouwt, ontstaan er uit dit RNA organellen die helpen bij de replicatie van het RNA. t-RNA en de ribosomen zijn speciaal gevouwen RNA ketens. Het RNA kan dus zowel de erfelijkheidsdrager zijn, maar tegelijk ook de gehele machinerie om zichzelf te kopieren.
De “verbetering” van het DNA ten opzichte van het “oudere” RNA zit in het controlesysteem na de replicatie. DNA kan op basis van de oude DNA-streng de nieuw geformeerde streng controleren op fouten. Bij enkelstrengs RNA is deze controle na replicatie niet mogelijk. DNA is dus een stabielere erfelijkheidsdrager dan RNA.
Wetenschappelijke ontwikkeling
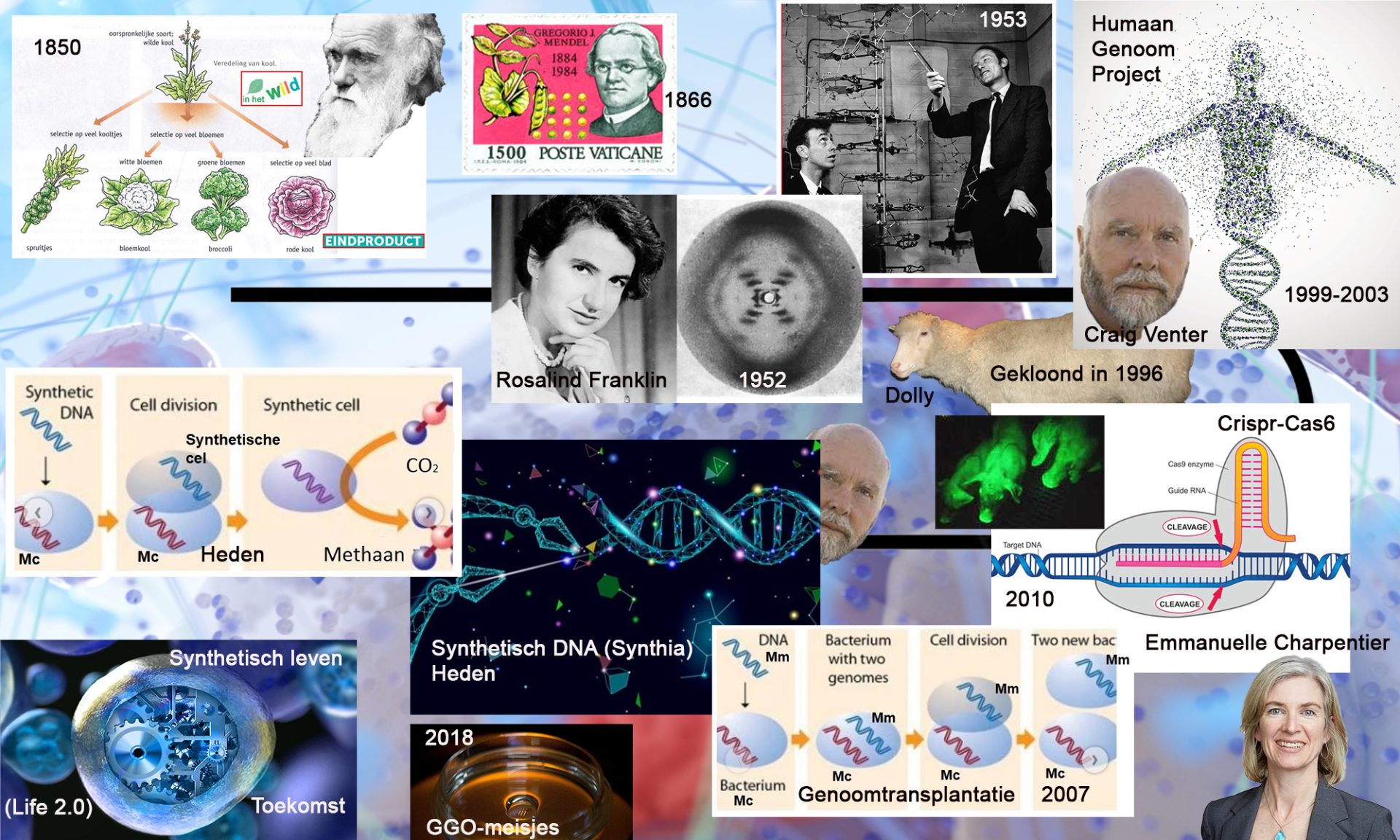
Tot ongeveer halverwege de vorige eeuw had men geen flauw idee hoe deze erfelijkheidsdrager er uit zou kunnen zien. Belangrijke wetenschappers waren in die tijd op zoek naar heel ingewikkelde structuren. Een molecuul dat zoveel informatie moest bevatten, moest immers zelf ook wel heel ingewikkeld in elkaar zitten.
Watson en Crick (bovenstaande wereldberoemde foto) waren de eerste die de daadwerkelijk structuur van het DNA ophelderden. Zij bepaalden dat het DNA moest bestaan uit een ruggengraat van suiker en fosfor en dat de genetische code geschreven moest zijn met de vier letters Guanine, Cytosine, Adenine en Thymine. Beide heren waren echter stom verbaasd over de simpelheid van het molecuul.
Sinds die tijd is het erg snel gegaan met de inzichten in het DNA en de mogelijkheden van het DNA. Omdat het molecuul zo simpel was, kon je er ook makkelijk mee knutselen. John Craig Venter is de ongekroonde koning van de moderne genetica. Met zijn bedrijfje Celera was hij de eerste op aarde die de volgorde van de drie miljard basenparen waar het menselijke genoom uit bestaat wist te bepalen.
Kort daarna heeft hij een volledig synthetisch genoom geproduceerd. Het was een kunstmatige kopie van een simpele bacterie. Het synthetische genoom heeft hij vervolgens ingebracht in een bacterie zonder DNA (genoom transplantatie), en de bacterie ging levenskenmerken vertonen op basis van die synthetische DNA. Venter noemde de bacterie die verder leefde met een kunst-genoomtransplantatie Syntia.
Ruggengraat van DNA vervangen
Maar de DNA-techniek raast maar voort. Een Amerikaans-Europees onderzoeksteam onder leiding van Phill Holliger heeft DNA ontwikkeld waarvan de ruggengraat niet bestaat uit suiker (ribose of deoxyribose) en fosfor, maar uit andere suikers als: arabinose, cyclohexaan of thereose. De naam van deze nieuwe erfelijkheidsdrager heet xna. X komt van het woord xeno. Dit is Grieks voor vreemd. Dit xna heeft vele voordelen. Het (afweersysteem van) het organisme waar je het in aanbrengt zal het niet herkennen en dus niet afbreken. Het is dus een stabiel molecuul en in staat fouten te maken bij de replicatie. Hieronder staat het betreffende artikel.
Bestudeer het artikel goed en probeer de bijbehorende vragen te beantwoorden.
Meerdere strategieën om de genetische code te veranderen
Het produceren van xna of het maken van een volledig synthetisch genoom is de uitdaging van de moderne gen-technologie. Een genoom samen stellen voor een micro-organisme, met eigenschappen die jij noodzakelijk vindt, is de uitdaging van de komende 20 jaar. Heden ten dage zijn het ambitieuze plannen met problemen die nog niet helemaal opgelost kunnen worden. Maar op kleinere schaal wordt er al jaren gemanipuleerd met erfelijk materiaal van organismen. Er worden veel verschillende technieken gebruikt, maar ze komen allemaal op het zelfde neer: een organisme krijgt erfelijke eigenschappen van een ander organisme ingebracht die het niet heeft, maar die de mens om verschillende redenen zeer wenselijk vindt. Het uitwisslen van genen tussen verschillende organismen, tussen verschillende genomen stelt één eis aan het DNA. Al het DNA van alle organismen op aarde moet hetzelfde zijn qua opbouw, qua manier om het af te lezen, qua manier om er een kopie van te maken, en qua manier om op deze kopie een eiwit te maken. Als er op aarde maar één erfelijkheidsdrager is, dan moet het mogelijk zijn om onbeperk eigenschappen te wisselen tussen organismen. Onderstaande video geeft een goede verklaring waarom er maar één soort erfelijkheidsdrager is. Alle organismen op aarde zijn aan elkaar verwant.
Diverse manieren van genetische modificatie zijn:
Genoomtransplantatie
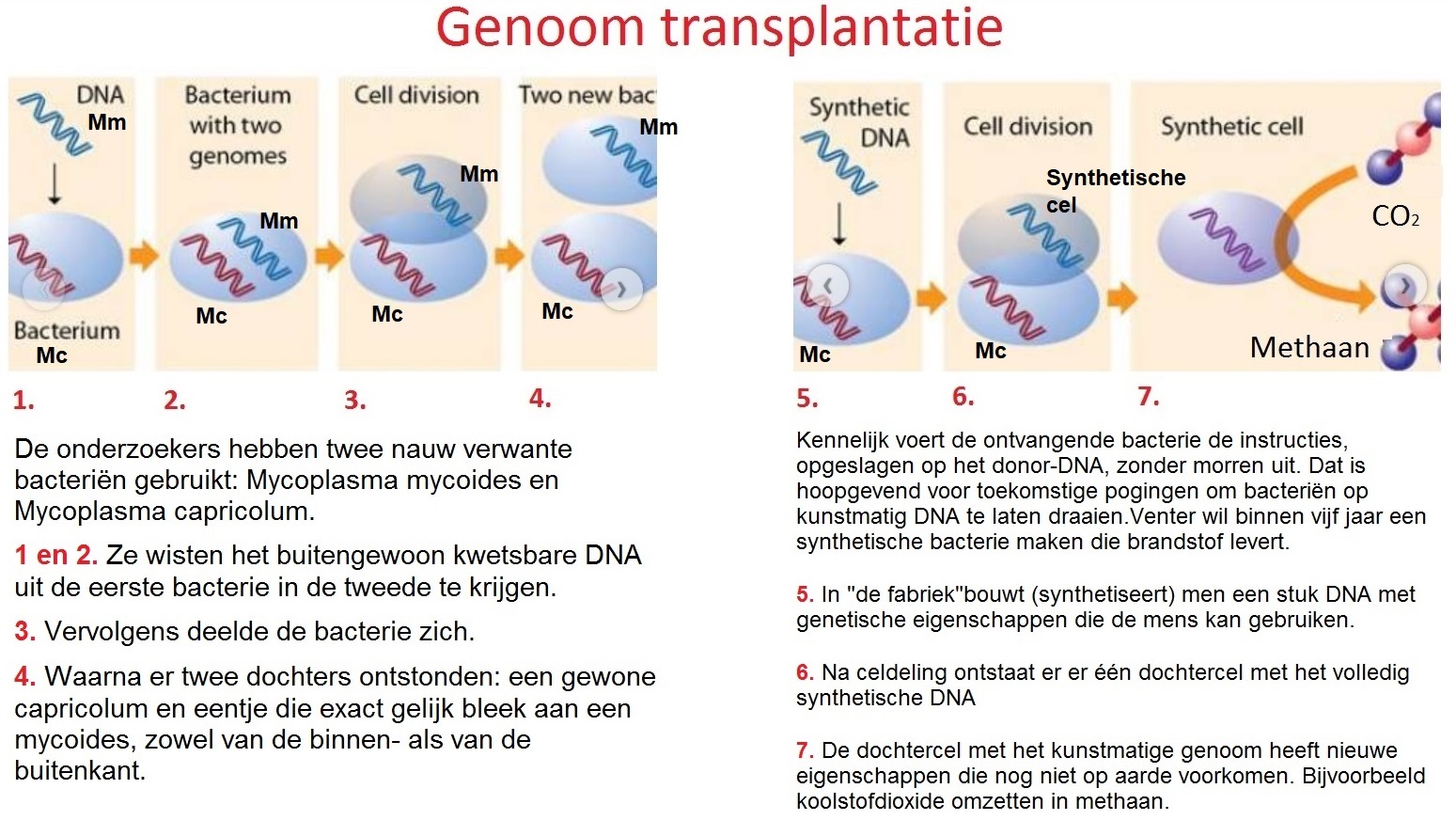
Amerikaanse moleculair-biologen hebben voor het eerst het volledige DNA van de ene bacteriesoort getransplanteerd naar een andere. Een belangrijke stap op weg naar ’synthetisch leven’.
Het brein achter deze zogeheten genoom-transplantatie, vandaag beschreven in het vakblad Science, is de beroemde Amerikaanse wetenschapper Craig Venter. Die heeft zich in zijn hoofd gehaald om eigenhandig een levende bacterie te creëren. Een bacterie die bijvoorbeeld goedkope brandstof produceert, of een medicijn.
Daarvoor zijn twee stappen nodig. Ten eerste moet er een ’levensvatbare’ DNA-code voor het nieuwe organisme worden gemaakt. En ten tweede moet zo’n code voorzichtig worden ingebracht in het lege (DNA-loze) omhulsel van een bacterie. In die tweede stap is de wetenschapper nu geslaagd, samen met collega’s van zijn eigen J. Craig Venter Institute in Rockville.
De onderzoekers hebben twee nauw verwante bacteriën gebruikt: Mycoplasma mycoides en Mycoplasma capricolum. Ze wisten het buitengewoon kwetsbare DNA uit de eerste bacterie in de tweede te krijgen. Vervolgens deelde de bacterie zich, waarna er twee dochters ontstonden: een gewone capricolum en eentje die exact gelijk bleek aan een mycoides, zowel van de binnen- als van de buitenkant.
Kennelijk voert de ontvangende bacterie de instructies, opgeslagen op het donor-DNA, zonder morren uit. Dat is hoopgevend voor toekomstige pogingen om bacteriën op kunstmatig DNA te laten draaien.
Venter wil binnen vijf jaar een synthetische bacterie maken die brandstof levert. Maar dat kan lastig worden. Zijn transplantatietechniek zal om te beginnen lang niet bij alle bacteriën werken. Veel bacteriën breken vreemd DNA af. Verder zullen synthetische bacteriën kwetsbaar zijn, omdat ze nauwelijks genen hebben waarmee ze zich kunnen aanpassen aan veranderingen.
Gentherapie
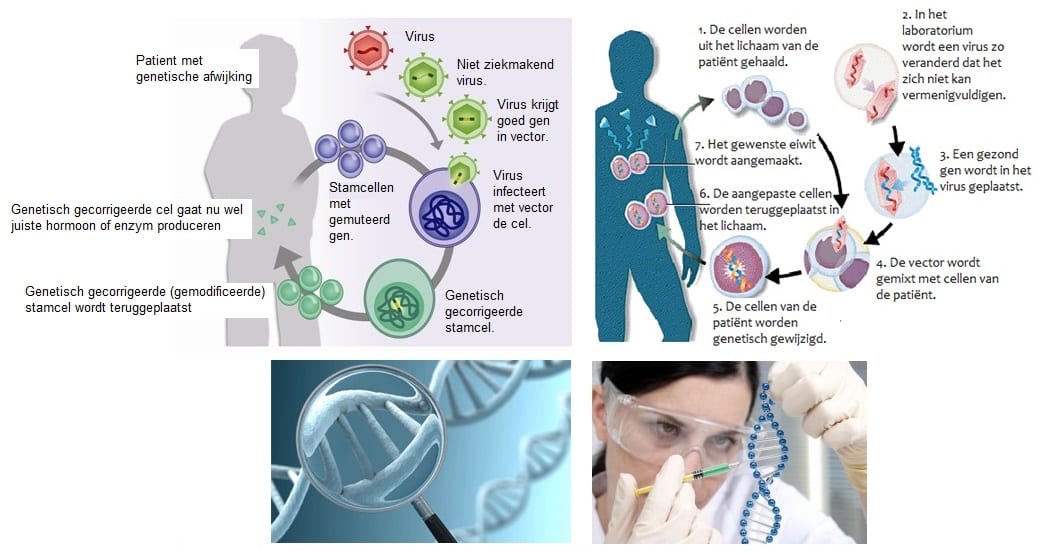
Gentherapie is het inbrengen van genetisch materiaal in (menselijke) cellen in het kader van een geneeskundige behandeling. Bij efelijke aandoeningen hoopt men dat dit genetisch materiaal kan dienen om een ziekte die ontstaat door een niet goed functionerend gen te genezen door een ‘gezond’ gen toe te voegen. Ook kan gentherapie in de toekomst misschien gebruikt worden om extra genen toe te voegen die kunnen bijdragen aan de genezing van complexe aandoeningen zoals hart-en vaatziekten
Een podcast van Biologielessen.nl op Spotify over het gen is hieronder te beluisteren.
Vector
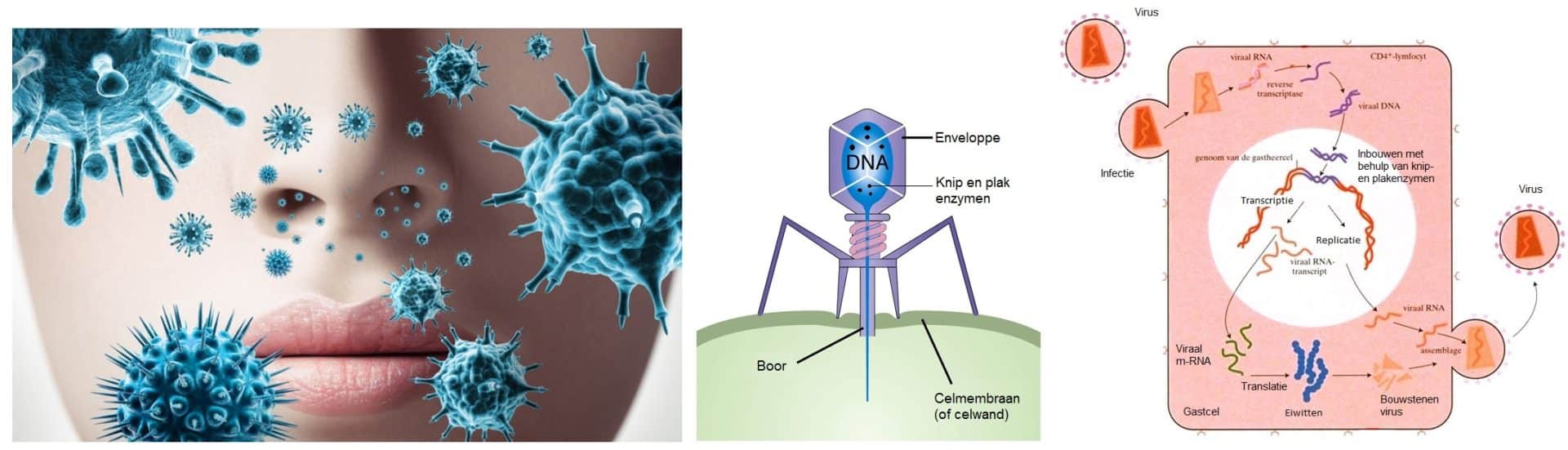
Dat lijkt makkelijk. Koppel de gen in de juiste cel en klaar. Maar zo werkt het niet. Al jaren zijn wetenschappers bezig om een goede manier te vinden om genoverdracht efficiënt genoeg te laten werken. Het celmembraan (een beschermend vliesje rond de cel) laat bijna nooit vanzelf een gen door. Om het te laten werken moet DNA worden gekoppeld aan een vector. Een vector is in de celbiologie en de moleculaire biologie de benaming voor een (vervoers)middel dat gebruikt wordt om genetisch materiaal (meestal DNA) in een cel of organisme in te brengen. Bijvoorbeeld een stof die versmelt met het celmembraan of een virus die juist gespecialiseerd is in het inbrengen van erfelijk materiaal in een plantaardige- , dierlijke-, of bacteriëlecel.
Een virus is vanwege zijn levenscyclus uitstekend geschikt als vervoersmiddel wan wenselijke erfelijke eigenschappen. Een virus is namelijk een meester in het overbrengen en inbouwen van virusgenen in het erfelijk materiaal van de gastcel die geparasiteerd wordt door het virus. In het besmette organisme gaat het virus op zoek naar een geschikte cel om te parasiteren. Heeft het virus deze gevonden dan hecht het virus zich aan de cel. Met een soort boor wordt het DNA (of RNA) inclusief wat enzymen ingebracht in de cel. Enzymen en viraal erfelijk materiaal zoeken gezamenlijk de celkern en het erfelijk materiaal van de gast op. In de celkern knippen de virale restrictie-enzymen het DNA van de gast open zodat het virale genoom ingebouwd kan worden. In feite is er nu een transgene cel ontstaan. Een organisme met extra nieuwe eigenschappen. Elke keer als de gastheercel zich gaat delen en het DNA moet worden verdubbeld, maakt de gast onbewust ook kopieën van het viraal DNA.
RNA-interferrentie
Een andere vorm van gentherapie is het door middel van RNA-inteferentie “stilleggen” van bepaalde genen. Bij RNA-interferentie wordt door speciale restrictie-enzymen m-RNA kapot geknipt. Hierdoor komt het gen niet via het m-RNA tot extressie in een eiwit. Hoewel de verwachtingen al decennia hoog gespannen zijn, is nog geen enkele vorm van gentherapie met behulp van RNA-interferentie op dit moment (2013) routinematig beschikbaar.
Bij erfelijke ziektes is er vaak sprake van een fout in het DNA, een zogenaamd defect gen. Dit defecte gen is op te sporen met technologie. Doordat een zieke een nieuw gen krijgt toegediend, zou de aandoening uiteindelijk te verhelpen moeten zijn, denken wetenschappers. Er zijn veel ziektes waarbij gentherapie uitkomst zou kunnen bieden. Denk aan kanker, aids, hemofilie en suikerziekte. Maar deze gentherapie staat nog in de kinderschoenen en wordt nog maar heel weinig
Recombinant-DNA-techniek
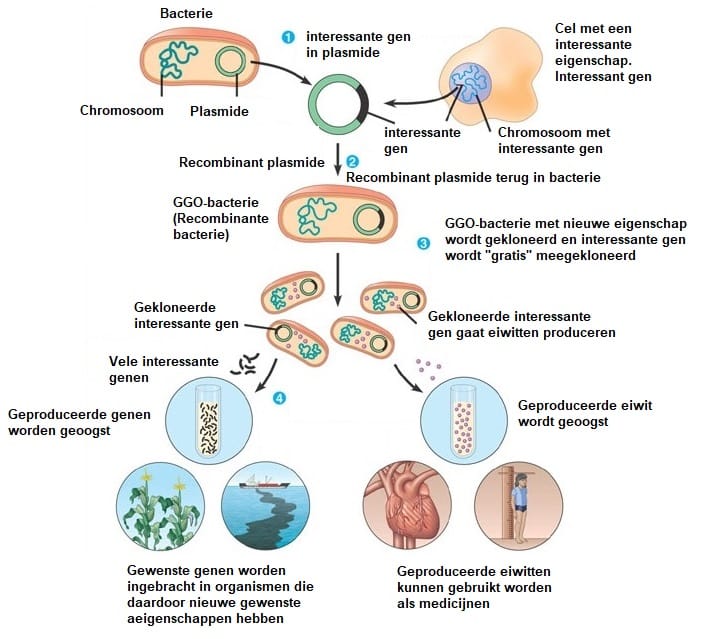
Bij recombinant-DNA-technieken ga je het genoom van een soort (een gast) veranderen. Verrijken met genen van andere organismen met nuttige eigenschappen. Genen zijn op twee manieren in te brengen bij de gastcellen. Via plasmiden kun je genen inbrengen bij bacteriën, maar ook met behulp van virussen kan je gewenste genen inbouwen in het DNA van een gastheer. De gast die het extra DNA ontvangt noemen we een transgeen, of gemodificeerd organisme. Deze transgene organismen kunnen op twee manieren worden gebruikt. Je kan met behulp van de gewenste genen organismen naar eigen inzichten verbeteren (Pad A van onderstaande illustratie). Door het inbrengen van een extra gen wordt een plant beter resistent tegen insectenvraat, kan de plant beter tegen droogte, of worden de vruchten groter en sappiger. Je kan ook een interessant gen inbouwen in een organisme met het idee dat het gen in de gastcel tot expressie wordt gebracht (Pad B van onderstaande illustratie, en de gehele 2e illustratie). Door transcriptie en translatie van het transcript kunnen eiwitten geproduceerd worden die heel zinvol zijn. De De transgene gast gaat eiwitten produceren die je graag wilt hebben. Groeihormonen, insuline en anti-klontermiddelen zijn geneesmiddelen die op deze manier verkregen worden
Hierboven zie je de twee manieren hoe gentherapie toegepast kunnen worden. Je kunt er dus organismen naar eigen inzicht mee verbeteren. Je kunt bijvoorbeeld planten voorzien van eigenschappen waardoor de beter bestand zijn tegen vraat, droogte of zout. Ook is het mogelijk bacteriën genetisch te modificeren waardoor ze wenselijke stofwisselingsproducten kunnen gaan maken. In het bovenstaande voorbeeld is er sprake van bacteriën die je een groeihormoon of een bloed anti-klontermiddel laat produceren.
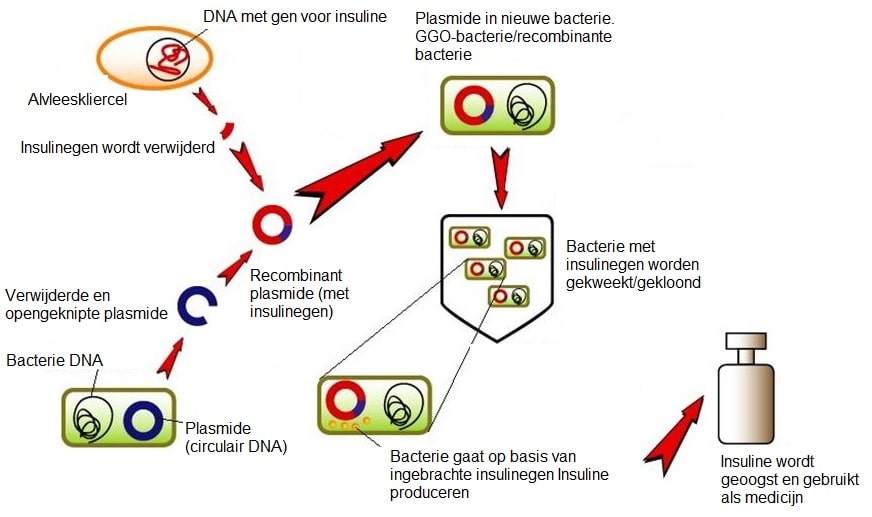
In onderstaande voorbeeld zie je hoe het mogelijk is om bacteriën een medicijn te laten maken. De cellen van de alvleesklier produceren insuline op het moment dat de bloedsuikerspiegel te hoog wordt. Bijvoorbeeld net na het eten. Insuline zorgt ervoor dat de bloedsuikerspiegel weer zakt. Bij mensen die suikerziekte hebben produceert de alvleesklier geen insuline. Van nature is een bacterie niet in staat om insuline te produceren. Door bij een bacterie een werkend insuline-gen in te brengen is deze bacterie ineens in staat om wel insuline te produceren. Als je dan voldoende bacterien bij elkaar hebt in een grote tank, dan is het mogelijk deze geproduceerde insuline te oogsten en te gebruiken als medicijn voor suikerpatiënten
Op 26 november 2018 staat het onderstaande artikel in het NRC
Chinese onderzoeker claimt eerste genetisch gemanipuleerde baby’s
Een Chinese onderzoeker claimt dat hij voor het eerst genetisch aangepaste kinderen heeft gemaakt. Zijn experimenten zijn nog niet gepubliceerd.
Lulu en Nana, een tweeling van meisjes, zouden de eerste genetisch veranderde baby’s ter wereld zijn, geboren in China. De baby’s zijn door de genetische ingreep beschermd tegen een aids-veroorzakende hiv-infectie.
Het DNA van Lulu en Nana is veranderd tijdens de bevruchting in een omstreden experiment. Jiankui He van de Southern University of Science and Technology of China in Shenzen heeft het experiment geleid. In een interview met persbureau Associated Press (AP) vertelde He maandag dat het experiment eerder deze maand resulteerde in de geboorte van een gezonde tweeling.
He zegt dat hij bij zeven vrijwilligers genetisch veranderde embryo’s in de baarmoeder heeft geplaatst, en dat het dus bij één stel tot een voldragen zwangerschap is gekomen. Dit is nog niet bevestigd door onafhankelijke bronnen, en evenmin beschreven in een wetenschappelijke publicatie.
Wetenschappers wereldwijd reageren verbaasd en geschokt op de bekendmaking van He. Opvallend is dat de universiteit waar Jiankui He werkzaam is, Southern University of Science and Technology, in een verklaring afstand neemt van de experimenten. Het onderzoek zou buiten de universiteit hebben plaatsgevonden. He zou volgens de universiteit sinds februari dit jaar met ‘onbetaald verlof’ zijn.
In veel landen verboden
In China hebben genetici eerder het DNA van menselijke embryo’s veranderd. Maar die proeven bleven beperkt tot het laboratorium, er werd nooit een kind uit geboren. In de meeste landen, waaronder Nederland, is het genetisch manipuleren van embryo’s verboden.
He beroept zich erop dat de Chinese academie van wetenschappen in 2017 heeft verklaard dat het voorkomen van infectieziekten „een ethische toepassing van gene-editing” is. Uit het protocol dat is opgeslagen in het Chinese register voor klinische proeven blijkt dat He voor het experiment getrouwde koppels met een kinderwens zocht, waarvan de man met hiv besmet was. Tijdens de ivf-procedure werd dan tegelijk met de spermacel de instructie voor de genverandering in de eicel geïnjecteerd.
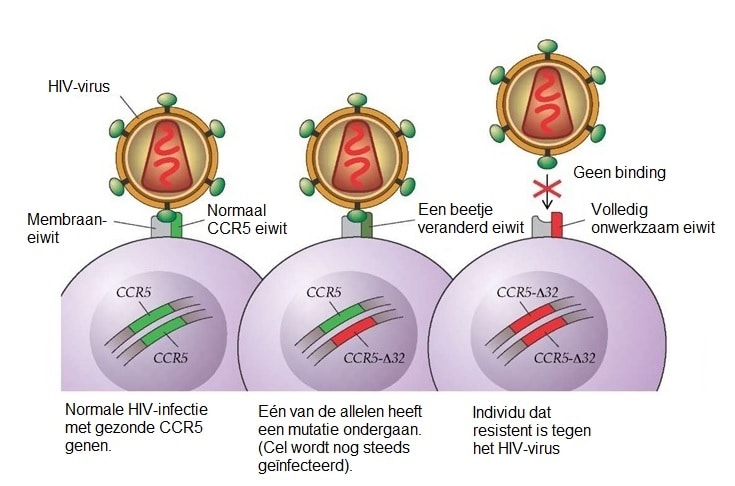
De genverandering gebeurde met de crispr-cas techniek. He knipte er een stukje mee uit het CCR5-gen. Dat gen bevat de informatie voor een receptormolecuul aan het celoppervlak, die hiv nodig heeft om binnen te dringen. Mensen met een bepaalde mutatie in dit molecuul zijn immuun voor hiv, zonder dat zij daar verder nadeel van lijken te ondervinden. Met crispr bracht He diezelfde mutatie kunstmatig aan in het CCR5-gen.
Link naar krantenartikel in het NRC inclusief video.